Investigadores de UC Riverside han realizado un descubrimiento innovador en el tratamiento del cáncer al desarrollar un péptido que puede controlar MYC, una proteína clave involucrada en la mayoría de los cánceres humanos. Esta innovación ofrece nuevas esperanzas para combatir el cáncer a nivel molecular, allanando el camino para tratamientos más eficaces.
El descubrimiento allana el camino para un tratamiento más eficaz.
Conozca MYC, la proteína deforme responsable de empeorar la mayoría de los casos de cáncer humano. Los investigadores de UC Riverside han encontrado una manera de controlarlo, lo que ofrece esperanza para una nueva era de tratamientos.
En las células sanas, MYC ayuda a guiar el proceso de transcripción, en el que la información genética se convierte de ADN en ARN y, eventualmente, en proteínas. “Normalmente, la actividad de MYC está estrictamente controlada. En las células cancerosas, se vuelve hiperactivo y no se regula adecuadamente”, dijo el profesor asociado de química de la UCR, Min Xue.
“MYC es menos alimento para las células cancerosas y más un esteroide que promueve el rápido crecimiento del cáncer”, dijo Xue. “Es por eso que MYC es el culpable del 75% de todos los casos de cáncer humano”.
Al inicio de este proyecto, el equipo de investigación de la UCR creía que si podían frenar la hiperactividad de MYC, podrían abrir una ventana en la que se podría controlar el cáncer.
Sin embargo, encontrar una manera de controlar MYC fue un desafío porque, a diferencia de la mayoría de las otras proteínas, MYC no tiene estructura. “Es básicamente una bola de azar”, dijo Xue. “Los procesos de descubrimiento de fármacos convencionales se basan en estructuras bien definidas, y eso no existe para MYC”.
Enfoque innovador para el descubrimiento de fármacos.
Un nuevo artículo sobre Revista de la Sociedad Química Estadounidensedel cual Xue es el autor principal, describe un compuesto peptídico que se une a MYC y suprime su actividad.
En 2018, los investigadores notaron que alterar la rigidez y la forma de un péptido mejora su capacidad para interactuar con objetivos proteicos no estructurados como MYC.
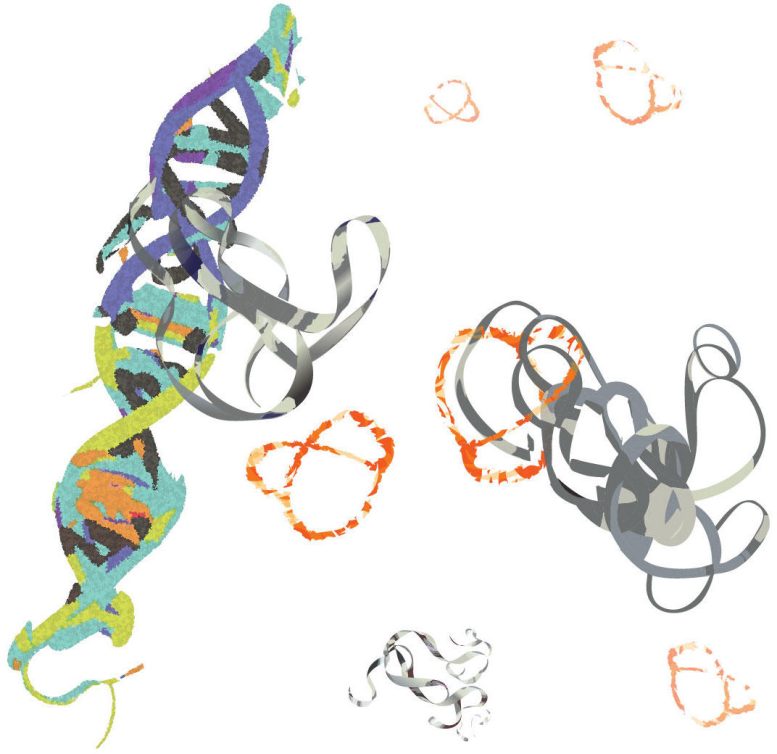
Las proteínas MYC (cintas grises) se unen al ADN y promueven la progresión del cáncer. Investigadores de la UCR han desarrollado una molécula (con forma de pretzel de naranja) que se une a MYC, inhibiendo su función promotora del cáncer. Crédito: Min Xue/UCR
“Los péptidos pueden adoptar una variedad de formas y posiciones”, dijo Xue. “Una vez que los doblas y conectas para formar anillos, no pueden adoptar otras formas posibles, por lo que tienen un bajo nivel de aleatoriedad. Ayuda con la conexión”.
Avances en la prestación de tratamientos y perspectivas futuras.
En el artículo, el equipo describe un nuevo péptido que se une directamente a MYC con lo que se llama afinidad submicromolar, que se acerca a la fuerza de un anticuerpo. En otras palabras, es una interacción muy fuerte y específica.
“Mejoramos el rendimiento de unión de este péptido con respecto a versiones anteriores en dos órdenes de magnitud”, dijo Xue. “Esto nos acerca a nuestros objetivos de desarrollo de fármacos”.
Actualmente, los investigadores están utilizando nanopartículas lipídicas para introducir el péptido en las células. Son pequeñas esferas formadas por moléculas grasas y no son ideales para su uso como medicamento. En el futuro, los investigadores están desarrollando sustancias químicas que mejoran la capacidad del péptido líder para ingresar a las células.
Una vez que el péptido esté en la célula, se unirá a MYC, cambiando las propiedades físicas de MYC e impidiendo que lleve a cabo actividades transcripcionales.
Este trabajo es posible en parte gracias a la financiación del Departamento de Defensa de EE. UU. y a la investigación médica dirigida por el Congreso y el Instituto Nacional de Salud.
El laboratorio de Xue en UC Riverside desarrolla herramientas moleculares para comprender mejor la biología y utiliza ese conocimiento para realizar el descubrimiento de fármacos. Durante mucho tiempo estuvo interesado en la química de los procesos caóticos, lo que lo llevó al desafío de domesticar MYC.
“MYC representa un caos, básicamente, porque carece de estructura. Eso, y su impacto directo en tantos tipos de cáncer, lo convierten en uno de los santos griales del desarrollo de fármacos contra el cáncer”, afirmó Xue. “Estamos muy entusiasmados de que ahora esté a nuestro alcance”.
Referencia: “Inhibidores dirigidos a MYC generados a partir de una biblioteca de péptidos bicíclicos estereodiversificados” por Zhonghan Li, Yi Huang, Ta I Hung, Jianan Sun, Desiree Aispuro, Boxi Chen, Nathan Guevara, Fei Ji, Xu Cong, Lingchao Zhu, Siwen Wang, Zhili Guo, Chia-en Chang y Min Xue, 3 de enero de 2024, Revista de la Sociedad Química Estadounidense.
DOI: 10.1021/jacs.3c09615

“Creador malvado. Estudiante. Jugador apasionado. Nerd incondicional de las redes sociales. Adicto a la música”.